【免疫抑制剂】他克莫司(Tacrolimus、タクロリムス)
他克莫司(英文:Tacrolimus;日文:タクロリムス)
别名:他克罗姆、FK-506、FR900506、TAC
一、剂型/规格:国内外上市、专利名称(proprietary name)批准机构
1. 胶囊
0.5mg:普乐可复、赛福开、福美欣、弘盛;Prograf FDA, EMA-部分国家、TacrolimusFDA;プログラフカプセルPDMA、タクロリムスカプセルPDMA、グラセプターカプセルPDMA;
1mg:普乐可复、赛福开、福美欣、异力抗、弘盛;Prograf FDA, EMA-部分国家 、TacrolimusFDA;プログラフカプセルPDMA、タクロリムスカプセルPDMA、グラセプターカプセルPDMA;
5mg:普乐可复、异力抗、Prograf FDA, EMA-部分国家、TacrolimusFDA;プログラフカプセルPDMA、タクロリムスカプセルPDMA;グラセプターカプセルPDMA;
2. 片剂
0.5mg、1mg、1.5mg、2mg、3mg、5mg:タクロリムス錠PDMA(中国未上市);
3. 注射液
5mg:1mL:普乐可复、 Prograf FDA, EMA-部分国家、TacrolimusFDA;プログラフ注射液PDMA;
2mg: 0.4mL:プログラフ注射液PDMA
4. 颗粒剂
0.2mg、1mg:他克莫司颗粒、Prograf FDA、Modigraf EMA、プログラフ顆粒PDMA;
5. 缓释胶囊
0.5mg、1mg、5mg:他克莫司缓释胶囊、Astagraf FDA、Advagraf EMA、Tacforius EMA;
6. 缓释片
0.75mg、1mg、4mg:EnvarsusFDA, EMA(中国未上市);
7. 软膏剂
0.1%(10g:10mg)、0.03%(3g:10mg):他克莫司软膏、普特彼、莱兹、ProtopicFDA、EMA;プロトピック軟膏0.03小児用PDMA; プロトピック軟膏0.1%PMDA;タクロリムス軟膏0.1%PMDA;
8. 滴眼液
0.1%(5mL:5mg以他克莫司计):他克莫司滴眼液、タリムス点眼液0.1%PDMA。
二、临床应用
1. 适应证:主要用于肝、肾移植的抗排异反应【1, 2, 3, 4, 5】,还可用于心【2, 3, 4】、肺、胰、小肠、骨髓、角膜移植的抗排异反应、重症肌无力【4】以及中重度特应性皮炎(软膏外用)、抗过敏治疗效果不明显的角结膜炎(滴眼液)等。
2. 用法用量【1-5】:
成人:他克莫司胶囊口服起始剂量为0.15~0.3 mg/(kg·d)(肾移植)、0.1~0.2 mg/(kg·d)(肝移植【1 , 3】)、0.075mg/(kg·d)(心脏移植【2, 3】),分2次口服(每隔12h一次【2】);再逐渐减至维持量0.1 mg/(kg·d),分2次口服,亦可根据实际情况调整,通常低于首次免疫抑制剂量【5】。如不能口服,则持续 24h静脉滴注,起始剂量为 0.05~0.1mg/(kg·d)(肾移植【1, 3】)、0.01~0.05 mg/(kg·d)(肝移植【1, 3】)、0.01~0.02 mg/(kg·d)(心脏移植【3】)。他克莫司应空腹给药,餐前1h或餐后2~3h【1, 5】。
儿童患者:口服起始剂量0.15~0.30 mg/(kg·d),分2次口服;如不能口服,则连续 24h静脉滴注,起始剂量【1, 3】为0.075~0.1mg/(kg·d)(肾移植)、0.05mg/(kg·d)(肝移植)、0.03~0.05mg/(kg·d)(心脏移植【3】)。0.1%的他克莫司软膏限成人使用;0.03%浓度的可用于2岁及以上的儿童【1, 4】。
三、治疗窗
为降低他克莫司毒性反应,应尽可能使其谷浓度低于20ng/mL(详见他克莫司中文说明书和FDA说明书首页、EMA说明书Page6、PMDA说明书7.3)【1-4】。
维持治疗期间,肝、肾、心脏移植患者其谷浓度通常建议维持在5~15 ng/mL范围【3-EMA-page6】;骨髓移植10~20ng/mL【4-PMDA(7.7)】。
1. 成人
肾移植:中国肾移植受者应用他克莫司联合MPA和糖皮质激素三联方案的目标浓度为术后1个月内8~12ng/mL,1~3个月6~10ng/mL,3~12个月4~10 ng/mL,1年以上4~8ng/mL。对于新生抗供体特异性抗体(de novo donor specific antibody,dnDSA)阳性且肾功能稳定的肾移植受者,建议维持他克莫司血药浓度> 6ng/mL(器官移植免疫抑制剂临床应用技术规范-2019版-四、2.3;表2)【6】。
肝移植:术后第1个月,目标浓度为10~15 ng/mL,第2、3个月为7~11 ng/mL,3个月以后为5~8 ng/mL,并维持在该水平。需要根据移植受者的类别调整目标浓度(他克莫司在临床肝移植中的应用指南-2015版,1-1.2)【7】。
心脏移植:术后前3个月10-15ng/mL;3~6月8~12ng/mL;之后5~10ng/mL(2019版中国心脏移植免疫抑制治疗及排斥反应诊疗规范-表1)【8】。
2. 儿童
肝移植:术后目标血药浓度第1个月内为8~12 ng/mL,第2~6个月为7~10 ng/mL,第7~12个月为5~8 ng/mL,12个月以后根据肝功能情况酌情维持在5 ng/mL左右(2015版中国儿童肝移植临床诊疗指南-3.6.1.1)【9】。肾移植:术后1个月内10~15 ng/mL,1~3个月8~15 ng/mL,3~12个月5~12 ng/mL,1年以上5~10 ng/mL【5】。
四、药代动力学特征【5】
他克莫司在人体内符合二室模型,一级吸收模型和一级消除模型。
1. 吸收 口服胶囊后约1~2 h达峰,口服吸收不完全,生物利用度25%,食物可影响其吸收。颗粒剂口服后约2~2.5h达峰,生物利用度比胶囊高20%左右【1】。他克莫司缓释剂型在肾移植患者的生物利用度可达40%,该制剂在胃内和/或近侧小肠1h内初始崩解,9h内在远端小肠或结肠完全崩解。同时给与健康受试者普通剂型和缓释剂型等效剂量(2 mg/d)时,他克莫司缓释剂型可显著降低峰谷波动率(1.85 vs. 2.59),延长到达Cmax的时间(8 vs. 2 h),显著提高平均血药浓度(5.93 vs. 3.92 ng/mL)、Cmax(8.39 vs. 7ng/mL)、Cmin(4.66 vs. 2.80 ng/mL)和浓度-时间曲线下面积(AUC0~24h)(142.27 vs. 94.15 ng·h/mL)值【5】。
2. 分布 进入血液后主要与红细胞结合(85~95%),血浆中约99%结合于血浆蛋白(主要是血清白蛋白和α1-酸性糖蛋白【2】),稳态全血分布容积47.7 L。
3. 代谢 主要由肝脏代谢,肠道和肾脏也有代谢,其主要代谢酶为CYP3A4。血浆清除率约0.6~5.4 L/(kg·h),平均消除半衰期约12 h(肝移植)、15.6h(肾移植)。他克莫司的药理活性主要以原型药为主;生物转化的主要机制是去甲基化和羟基化【2,4】。体外研究(PMID: 7507815,17965516)显示,他克莫司与人肝微粒体孵育后的主要代谢物是13-去甲基他克莫司;31-去甲基代谢物与原药具有相同活性【2】。
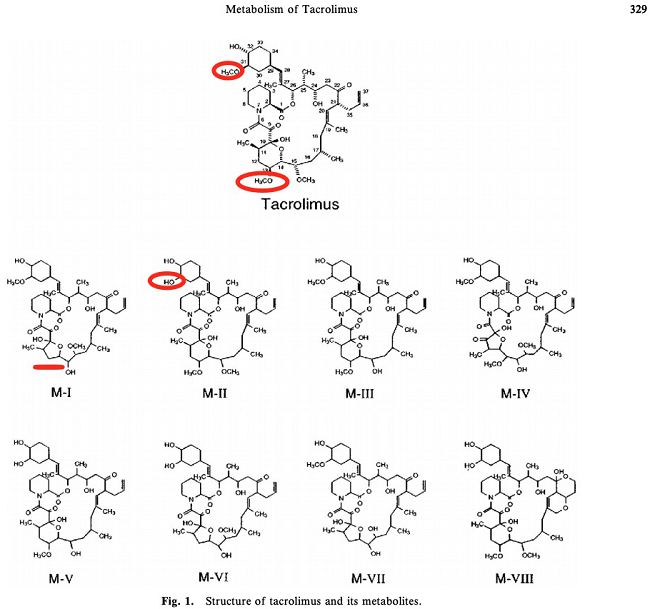
(图片来源:PMID 17965516)
4. 排泄 约80~95%通过粪便排泄,其中99%以上以代谢物的形式排泄【5】。
五、不良反应【5】
1. 感染:同其它其他免疫抑制剂,使用他克莫司的患者对病毒、细菌、真菌和/或原虫感染的可能性会增加。已有的感染性疾病可能还会加重。
2. 肾脏:肾功能异常(血肌酐升高、尿素氮升高、尿量减少)频发。
3. 血糖代谢:出现高血糖和糖尿病。
4. 神经精神系统:震颤、头痛和失眠十分常见。惊厥发作、意识障碍、周围神经疾病、头晕、感觉异常和感觉迟钝,精神错乱和定向障碍、抑郁、焦虑、幻觉。
5. 心血管系统:常出现高血压;各种缺血性冠状动脉疾病、心动过速。
6. 血液及淋巴系统:常见贫血、血小板减少、白细胞增生或白细胞减少和红细胞分析异常;偶见凝血功能障碍、全血细胞减少症。
7. 电解质及其它其他代谢性疾病:高血钾和低血钾,血镁、血钙、磷酸、血钠浓度下降;高尿酸血症和酸中毒。
8. 胃肠道系统/肝:偶发性腹泻、恶心、便秘、脱水、消化不良、胃肠道出血、呕吐,以及肝功能检查异常和黄疸。
9. 呼吸系统:常见实质性肺病、呼吸困难、胸腔积液、咳嗽、咽炎、鼻充血和炎症。偶见呼吸衰竭和哮喘。
10. 感觉系统:视觉异常包括弱视、白内障、畏光,听觉疾病包括耳鸣和耳聋。
11. 皮肤:脱发、多毛、瘙痒、出汗和皮疹。
12. 肌肉骨骼:关节痛、肌痛、腿痛性痉挛、肌肉张力过高和痉挛。
13. 全身性疾病及给药部位反应:发热、疼痛和不适、虚弱状态、水肿、体温感觉障碍。
六、TDM方法
1. 采血时间点:应在下一次剂量前抽血检测【5】。
2. 采血类型:目前通常为静脉全血样本(EDTA抗凝)【2】。由于他克莫司在T淋巴细胞内部发挥作用,细胞内药物浓度可能是更直接的药效学指标,详细方法可参考2020年IATDMCT制定的细胞内CNI监测专家共识【10】。
3. 监测频率:推荐移植术后早期可每周检测2次,随后维持治疗期间可定期检测【5】。
4. 监测指征:剂量调整、治疗方案改变、发生毒性反应或排斥反应征兆、转换药品剂型和品牌,都需要采样测定【1, 3】。
5. 样本保存:若不立即进行分析,样本可室温储存,或储存于冰箱(2~8℃)可在7天内分析; -20℃冻存6个月后的回收率约为90%【2】。共识中指出,4~22℃ 14天或-20℃ 1个月、-70℃ 1年不影响样本的稳定性【11】。
6. 检测方法:RIA,CMIA,EMIT,MEIA,ELASA,HPLC,LC-MS/MS【6, 11】;IATDMCT免疫抑制药物科学委员会总结的LC-MS/MS定量步骤包括样品制备、色谱分离、质谱参数选择与测定、数据处理和确认:50μL EDTA全血加入250μL去离子水和750μL甲醇-硫酸锌溶液(V甲醇:V硫酸锌溶液0.1mol/L= 2:1),室温下涡旋混合,4℃离心;固定相采用C18或C8色谱柱、柱温设在35℃~75℃之间,流动相成分应为色谱纯,同时检测他克莫司和其他免疫抑制剂时需将峰型和背景调整到可接受的范围;质谱采用电喷雾电离、正离子模式(m/z 821.5→ m/z 768.5);建议使用稳定同位素内标(例如13C, D2-TAC)以降低基质效应【11】。
受者的个别情况会干扰浓度测定结果,应注意分析。以CMIA 法为例,当总胆红素>684μmol/L、甘油三酯>20.8mmol/L或尿酸>2380μmol/L时,实际结果<测定值12%; 如有胆汁淤积时,实际结果<测定值;经小鼠单抗治疗的受者,血中可能产生了抗鼠抗体,会影响测定结果【6】(器官移植免疫抑制剂临床应用技术规范-2019版,2-2.2)。
七、注意事项【5】
1. 食物 合用葡萄柚或葡萄柚汁可升高他克莫司的全血谷浓度,增加不良反应的发生。禁食状态下他克莫司的吸收速率和程度最大,进食可降低本药的吸收速率和程度,在高脂饮食(848kcal,脂肪含量为46%)下这种作用最为明显。
2. 年龄 没有证据表明老年患者需进行剂量调整;儿童尤其是幼儿期,总清除率和半衰期随年龄不同高度变化【1】。
3. 疾病 肾功能不全时无需调整剂量,重度肝功能损害者可能需减量,以确保全血谷浓度在推荐的目标范围内。患有半乳糖不耐症、Lapp乳糖酶缺乏症或葡萄糖-半乳糖吸收障碍等罕见遗传疾病的患者应避免使用含有乳糖成分的颗粒剂【1】。
4. 药物【5】
(1)他克莫司用药过程中,应避免同时使用神经毒性药物、肾毒性药物、高钾摄取或保钾利尿药;
(2)他克莫司血浆蛋白结合率高,避免合用其它其他血浆蛋白结合率高的药物;
(3)他克莫司主要通过CYP3A4代谢,因此与CYP3A4诱导剂或抑制剂合用时会影响他克莫司的代谢。抗真菌药物(酮康唑、氟康唑、伊曲康唑、伏立康唑),大环内酯类药物、HIV蛋白酶抑制药(如茚地那韦、奈非那韦、利托那韦、沙奎那韦)、HCV蛋白酶抑制剂(如替拉瑞韦、波塞普韦)可导致他克莫司胃肠道代谢被抑制,血药浓度显著升高。克霉唑、克拉霉素、交沙霉素、硝苯地平、尼卡地平、地尔硫卓、维拉帕米、胺碘酮、达那唑、炔雌醇、奥美拉唑、奈法唑酮等对他克莫司血药浓度的影响较小。利福平、苯妥英、贯叶连翘(圣约翰草【2-4】)可通过诱导CYP3A4而降低他克莫司的血药浓度。卡马西平、安乃近、异烟肼可潜在地降低他克莫司血药浓度。
(4)与强碱性药物配伍,他克莫司可被分解。
(5)免疫抑制剂可能影响对疫苗的应答,他克莫司治疗期间接种疫苗可能导致疫苗效力降低。
八、遗传药理
他克莫司的主要代谢酶是CYP3A4和CYP3A5,CYP3A5的表达差异对他克莫司的首关代谢和代谢清除的影响更为敏感。临床药物基因多态性实施联盟(Clinical Pharmacogenetics Implementation Consortium,CPIC)2015年发布的关于CYP3A5基因型与他克莫司给药剂量的指南【12】中强推荐他克莫司快代谢型(CYP3A5 *1/*1)患者的给药剂量可增加到推荐起始剂量的1.5~2倍,不超过0.3mg/(kg·d)。
2019年IATDMCT在他克莫司个体化治疗TDM专家共识第2版【11】中补充了基于CYP3A4*22群体药代动力学的推荐剂量(下表)。
标准推荐给药剂量:0.15mg/(kg·d) | ||
基因型 | 推荐调整剂量 | 依据 |
0.15 | CPIC-2015指南【12】 | |
CYP3A5 *3/*3+ CYP3A4 *22 | 0.14 | 基于PPK模型【11】 |
CYP3A5 *3/*3+ CYP3A4 *1/*1 | 0.2~0.25 | 基于PPK模型【11】 |
CYP3A5 *1/*3 | 0.3 | CPIC-2015指南【12】 |
CYP3A5 *1/*1 | 0.3 | CPIC-2015指南【12】 |
CYP3A5 *1 + CYP3A4 *1/*1 | 0.3~0.4 | 基于PPK模型【11】 |
CYP3A5基因第3内含子内22893位存在6986A>G的突变(rs776746,CYP3A5*3),该SNP可导致CYP3A5mRNA异常剪接,引起终止密码子过早剪切CYP3A5蛋白,从而使其失去酶的活性,因此CYP3A5*3纯合子个体肝脏和肠道CYP3A5蛋白表达和活性显著下降。CYP3A5*1等位基因频率存在显著种族差异,中国人群中为28%【13】。欧洲科学家委员会的建议:CYP3A5*3/*3基因型患者他克莫司的起始剂量为0.15 mg/(kg·d);CYP3A5*1/*3基因型患者他克莫司的起始剂量为0.20 mg/(kg·d);CYP3A5*1/*1基因型患者他克莫司的起始剂量为0.25 mg/(kg·d)。中国人群根据CYP3A5*3基因型给予初始剂量:CYP3A5*3/*3基因型患者他克莫司的起始剂量为0.075 mg/(kg·d);CYP3A5*1/*3和CYP3A5*1/*1基因型患者基因型患者他克莫司的起始剂量为0.15 mg/(kg·d)【13】。
基于中国人群的他克莫司用药剂量公式【13】:他克莫司维持剂量=5.409–2.584*CYP3A5GGa–1.732*CYP3A5GAb+0.279*ABCB1C 1236Tc+0.205*ABCB1G2677Td-0.163*移植类型e-0.149*CCBf-0.140*感染g -0.197*高血压h
a. CYP3A5GG:GG=1,AA=0;
b. CYP3A5AG:AG=1,AA=0;
c. ABCB1C1236T:CT=1,TT=1,CC=0;
d. ABCB1G2677T:GG=1, GT=1, TT=2;
e. 移植类型:活体移植=1,其他=0;
f. CCB:合并使用钙通道阻滞剂=1,不合并=0;
g. 感染:感染=1,未出现=0;
h. 高血压:高血压=1,未出现=0。
参考文献
【1】中国国家药品监督管理局NMPA 药品信息和国内已上市药品的说明书
(国内药品说明书参考药智网数据库和相关企业官网信息)
【2】美国Food&Drug Administration (FDA) Approved Drugs
https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/050708s050,050709s042,210115s002lbl.pdf普乐可复说明书(更新至2019年6月)
https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/204096s007lbl.pdf ASTAGRAF XL缓释胶囊说明书(更新至2019年6月)
https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/050777s018lbl.pdf 他克莫司软膏说明书(2011年4月)
【3】欧洲European Medicines Agency(EMA)
https://www.ema.europa.eu/en/documents/referral/prograf-article-30-referral-annex-i-ii-iii_en.pdf (Prograf资料,EC)
https://www.ema.europa.eu/en/documents/product-information/modigraf-epar-product-information_en.pdf (他克莫司颗粒,更新至2019年10月31日)
https://www.ema.europa.eu/en/documents/product-information/advagraf-epar-product-information_en.pdf (他克莫司缓释胶囊,更新至2020年5月6日)
【4】日本医药品医疗器械综合机构(PDMA)药品批文
https://www.pmda.go.jp/PmdaSearch/iyakuDetail/800126_3999014M1022_3_38#HDR_Warnings(胶囊,更新至2020年4月)
https://www.pmda.go.jp/PmdaSearch/iyakuDetail/800126_3999014D1022_3_28#HDR_Warnings(颗粒剂,更新至2019年6月)
https://www.pmda.go.jp/PmdaSearch/iyakuDetail/480235_3999014F1023_1_17#WARNINGS (片剂,更新至2017年9月)
https://www.pmda.go.jp/PmdaSearch/iyakuDetail/730155_2699709M1028_4_05#HDR_PediatricUse(软膏0.1%,更新至2020年9月)
https://www.pmda.go.jp/PmdaSearch/iyakuDetail/380086_1319755Q1028_1_08#CONTRAINDICATIONS (滴眼液0.1%,更新至2018年7月)
【5】免疫抑制剂-他克莫司. 张相林等. 治疗药物监测临床应用手册[M], 人民卫生出版社, 2020: 251-256. https://www.pmphmall.com/gdsdetail/637932-315530
【6】田普训,敖建华,李宁,石炳毅.器官移植免疫抑制剂临床应用技术规范(2019版)[J].器官移植, 2019, 10(03): 213-226. http://www.xmL-data.org/qgyz/htmL/894.htmL
【7】他克莫司在临床肝移植中的应用指南[J].临床肝胆病杂志, 2015, 31(09): 1372-1374.http://www.lcgdbzz.org/content.asp?id=7005
【8】黄洁, 廖中凯. 中国心脏移植免疫抑制治疗及排斥反应诊疗规范(2019版)[J].中华移植杂志(电子版), 2019, 13(01): 15-20. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFD&filename=ZYZD201901004
【9】夏强.中国儿童肝移植临床诊疗指南(2015版)[J].临床肝胆病杂志,2016,32(07):1235-1244. http://www.lcgdbzz.org/content.asp?id=7775
【10】Lemaitre F, Vethe NT, DʼAvolio A, et al. Measuring Intracellular Concentrations of Calcineurin Inhibitors: Expert Consensus from the International Association of Therapeutic Drug Monitoring and Clinical Toxicology Expert Panel. Ther Drug Monit. 2020,42(5):665-670. https://pubmed.ncbi.nlm.nih.gov/32520841/
【11】Brunet M, van Gelder T, Åsberg A, et al. Therapeutic Drug Monitoring of Tacrolimus-Personalized Therapy: Second Consensus Report. Ther Drug Monit. 2019,41(3):261-307.
https://journals.lww.com/drug-monitoring/Fulltext/2019/06000/Therapeutic_Drug_Monitoring_of.2.aspx
【12】Birdwell KA, Decker B, Barbarino JM, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) Guidelines for CYP3A5 Genotype and Tacrolimus Dosing. Clin Pharmacol Ther. 2015,98(1):19-24. doi:10.1002/cpt.113
https://cpicpgx.org/guidelines/guideline-for-tacrolimus-and-cyp3a5
【13】国家卫计委.药物代谢酶和药物作用靶点基因检测技术指南(2015版).
http://www.nhc.gov.cn/cms-search/xxgk/getManuscriptXxgk.htm?id=fca7d0216fed429cac797cdafa2ba466
(以上内容更新于2021年1月31日)
本站相关课件资料:
IATDMCT他克莫司共识解读-闫美玲.pdf
基于PK的肾移植患者的免疫抑制剂个体化用药-马葵芬.pdf
http://www.ctdm.org.cn/index.php?s=/Meeting/metResourcesById/id/611da6a5dd34469fac71d411412964ab/meetingid/
缩略词:
ACMIA:抗体结合磁免疫分析(antibody-conjugated magnetic immunoassay)
RIA:放射免疫测定(radioimmunoassay)
CMIA:化学发光微粒免疫分析(chemiluminescent microparticle immunoassay)
ECLIA:电化学发光免疫分析(electrochemiluminescence immunoassay)
EMIT:酶倍增免疫分析技术(enzyme-multiplied immunoassay technique)
IATDMCT:国际治疗药物监测和临床毒理学会(International Association of Therapeutic Drug Monitoring and Clinical Toxicology)
MEIA:微粒子酶免疫法(microparticle enzyme immunoassay assay)
QMS:定量微球系统(quantitative microsphere system)
-
 崔昊男
崔昊男 -
赞2021-09-01

 京公网安备11010502042549号
京公网安备11010502042549号