CAR-T细胞疗法现在与未来
-

-
专家 艾超副主任药师北京清华长庚医院院办主任/药学部副主任
肿瘤现况及治疗方案
肿瘤严重威胁民众的健康安全。据估计,2015年我国新发恶性肿瘤病例数约为392.9万例,2014年为380.4万,较2014年增加12.5万,增长率为3.2%。平均每天超过1万人被确诊为癌症,每分钟有7.5个人被确诊为癌症。2015年全国恶性肿瘤死亡例数约为233.8万例,2014年为229.6万,2015年较2014年增加4.2万,增长率为1.8%。
目前国内外治疗肿瘤的方法主要有:手术、放化疗、靶向治疗和免疫治疗。
(1)手术治疗快速,效果好,对部分肿瘤能切底治愈。缺点是手术切除肿瘤的时候都是尽量扩大切除部位,对患者带来了一定的损伤。对无法手术的肿瘤手术无能为力。
(2)化疗可以快速的杀死肿瘤细胞,对早期的肿瘤患者疗效较好。缺点是化疗药物不良反应多,许多患者不能耐受;放疗同样可以在早期快速的杀伤肿瘤细胞。缺点是放疗所采用的放射线也没有选择性,会产生放射性皮炎、放射性食管炎以及食欲下降、恶心、呕吐、腹痛、腹泻或便秘等诸多毒副反应。
(3)靶向治疗副作用小,针对性强。缺点是需要基因检测确认患者具有相应的基因突变,不适用于所有患者;持续使用后会产生耐药情况,影响预后,且大部分靶向药物价格昂贵。
(4)免疫治疗对人体的副作用小,效果较好。缺点是杀伤肿瘤细胞速度慢,需依赖人体自身免疫系统功能;目前所采用的免疫治疗都存在不同程度的免疫逃避现象,降低了免疫治疗的效果。
免疫疗法的原理
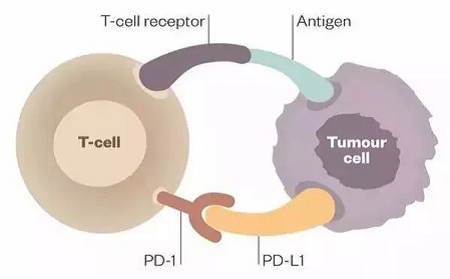
正常情况下人体对肿瘤产生免疫反应,促进抗原特异性T细胞增生。肿瘤细胞逃避T细胞摧毁的一种途径就是通过在它的表面产生PD-L1,当免疫细胞T细胞表面的程序性死亡受体-1(PD-1)识别PD-L1后,可以传导抑制性信号,T细胞就不能发现肿瘤细胞和向肿瘤细胞发出攻击信号,抑制T细胞活化使癌细胞逃离免疫杀伤。如图1所示。
图1 免疫逃逸的原理
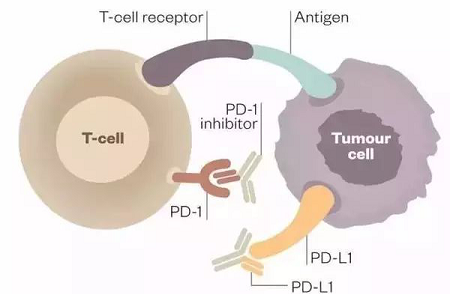
PD-1抑制剂是通过解除肿瘤细胞逃避免疫系统的免疫疗法。PD-1免疫疗法的作用机制是针对PD-1或PD-L1设计特定的蛋白质抗体,通过结合靶位点阻止PD-1和PD-L1的识别过程,部分恢复T细胞功能,从而使T细胞可以杀死肿瘤细胞。如图2所示。
图2 PD-1/PD-L1抑制剂作用原理
CAR-T细胞技术的原理及研究进展
CAR-T疗法全称为Chimeric antigen receptor T cell immunotherapy,即嵌合抗原受体T 细胞免疫疗法。 这一概念最早由Gross等[1]于1989年提出,经过近几年连续改进和发展后在科研及临床都得到了巨大的进步。 CAR-T细胞技术属于过继性T细胞疗法的一种,但其鲜明的特点在于可使 T细胞表面表达嵌合抗原受体,从而引导 T细胞靶向杀伤肿瘤细胞。 相对于传统过继性细胞疗法而言,CAR-T细胞技术可以绕过抗原递呈的步骤,进入人体后能长期存活或继续繁殖。 由于CAR-T细胞疗法展现出的极强的技术属性和良好的复制性,和目前在血液系统肿瘤治疗中表现出良好的临床疗效,吸引了越来越多的研发机构和生物医药企业投入其中,促进了产业的进一步发展。
1、CAR-T的结构与功能
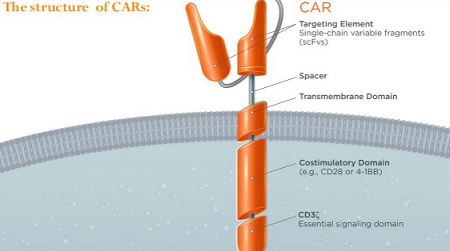
经典的嵌合型抗原受体 CAR( chimeric antigen receptor)可分为5个部分,即识别肿瘤抗原的抗体单链可变区(Targeting Element)、铰链区(Spacer)、跨膜区(Transmembrane Domain)、共刺激区(Costimulatory Domain)和T细胞活化区(Signaling Domain)。具体见图3。
图3 CAR的结构
CAR-T 技术通过外源基因转染技术转染到患者的T 细胞或者改造的T 细胞,把识别肿瘤相关抗原(Tumor Associated Antigen, TAA)的单链抗体(Single Chain variable fragment, scFv)和T细胞活化序列(通常为CD3ζ 或 FcεRIγ)的融合蛋白表达到T细胞表面。 ScFv通过跨膜区与T细胞胞内的活化增殖信号域偶联。这些改造的T细胞再经过体外纯化和大规模扩增后回输到患者体内,最终以非主要组织相容性复合体(Major Histocompatibility Complex, MHC)限制性模式表现强效的抗癌作用。CAR-T细胞作用过程不受MHC限制,这在一定程度上使得CAR-T细胞技术具有多靶点性,而且对表达相同抗原的肿瘤均具有识别杀伤能力。迄今,CAR-T细胞技术主要经历了 4代研发历程,但也有研究提出第5代应为通用型嵌合抗原受体,具体见表1和图4。
表1 各代CAR-T细胞的技术比较
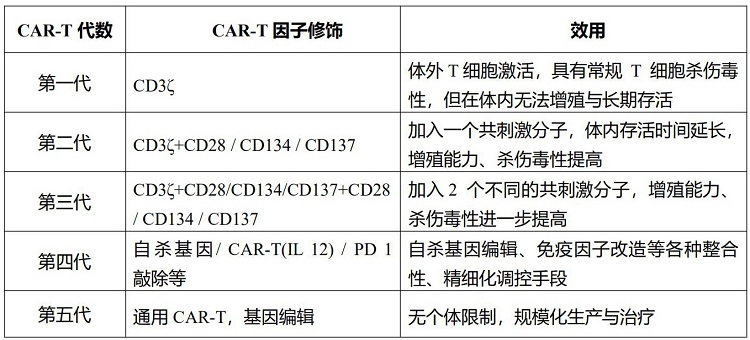
图4 各代CAR-T细胞的结构
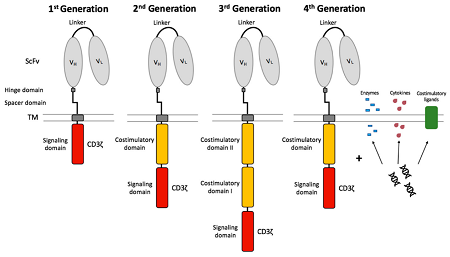
2、CAR-T研究进展
与手术、放疗、化疗等肿瘤的传统治疗方法相比,CAR-T细胞疗法具备许多优势,如:体内存续时间久、靶向性更强、较低的毒副作用等,尤其是对于难治性恶性肿瘤的缓解。CAR-T目前已成功应用于多种肿瘤疾病的临床试验,包括黑色素瘤、乳瘤等,尤其在血液系统恶性肿瘤中的成果可以说是革命性的。
(1)血液系统肿瘤领域
CAR-T 细胞技术已成为目前最有希望根治恶性血液病且不依靠异体干细胞移植的新型技术,也是连接移植的重要桥梁或移植后清除残存肿瘤细胞的重要武器。其中以B细胞表面标志物CD19为治疗靶点构建的CAR-T细胞,是迄今临床应用最广泛也最成熟的CAR-T疗法。Sadelain等[2]研究团队于2015年发 表抗CD19 CAR-T治疗33例成人的成果,16例MRD阳性的患者在输注后获得 91% CR和82% MRD阴性的优异结果,该项研究曾于2015年美国血液学大会上展示。2018年Park等[3]一 期临床研究治疗51例成人复发性、难治性 (r/r) 急性淋巴细胞白血病(Acute lymphoblastic leukemia, ALL),缓解率为83%,中位随访29个月,最长生存期达65个月,在低负荷白血病的患者中,总生存期可达20.1个月。2018年,我国研究人员[4]对18例复发或难治的ALL患者进行了人源化的抗 CD19-CAR-T 细胞治疗,总体反应率达92.9%,180天累计复发率为22.6%,总体疗效与国外CD19-CAR-T治疗的效果相当。目前国内其他中心的自体 CD19 CAR-T 治疗复发或难治B-ALL的疗效已经达到甚至超过国际同行的水平。
BCMA是骨髓瘤细胞的抗原靶点,在一项试验中,19名患有 r/r多发性骨髓瘤的患者的评估报告中,有7名患者随访时间达6个月以上,ORRs接近 100% ,结果令人兴奋。CD33和CD123也是骨髓白血病的靶点,在我国也已进行了多项靶向相关抗原的CAR-T细胞试验。
(2)实体肿瘤领域
实体瘤研究也取得了部分令人欣喜的成绩研究发现。在2015年美国临床肿瘤学会年会上,公布了 CAR-T 细胞技术首次在实体瘤胰腺癌治疗上的突破,6 例受试者中有1例转移灶部分消失,4例肿瘤代谢趋于稳定或降低,并且发现相应的 CAR-T细胞已经转移到患者肿瘤部位[5]。其后,一项针对19例复发或转移的 Her2阳性肉瘤患者采用 HER2 CAR-T细胞治疗的I/ II临床试验显示[6],患者的中位生存期达10.3个月 (5.1~29.1个月) 。
我国在运用CAR-T治疗实体瘤领域也成果突出。2019年,科济生物团队和上海交通大学医学院附属仁济医院研究团队合作[7],发表了国际上首篇针对CLDN18.2靶点的CAR-T细胞研究论文, 试验中12名患有进展期胃癌和胰腺腺癌的患者(18~70岁)接受了自体CLDN 18.2 CAR-T细胞治疗。研究结果表明:截至2018年11月30日, 11名可评估受试者中,完全缓解1例(胃腺癌),部分缓解3例(胃腺癌2例,胰腺腺癌1例),病情稳定5例,病情进展2例。客观缓解率为33.3%,无疾病生存期PFS中位值为130天[95% CI(38,230)]。
2020年,来自中国上海交通大学医学院的研究人员[8]首次报告了靶向磷脂酰肌醇蛋白聚糖3(GPC3)的CAR-T细胞疗法治疗肝细胞癌结果。在这项研究中,13名患有晚期GPC3+HCC(Child-Pugh A)的成年患者接受了自体CAR-T细胞治疗,随访的3年、1年、6个月的总生存率分别为10.5%、42.0%和50.3%。此外,其中1名患者在治疗44.2个月后仍然存活。
3、CAR-T未来发展
CAR-T细胞疗法治疗效果明显,逐渐成为未来肿瘤治疗的发展方向,被称为继手术、放疗和化疗之后的第四大肿瘤治疗技术。目前,CAR-T细胞疗法在白血病、淋巴瘤、多发性骨髓瘤的治疗中展现出非常好的治疗结果。
我们也需要注意,尽管CAR-T疗法具有特异性高、疗效显著、副作用低等优点,但常见的副作用包括细胞因子释放综合征、脱靶毒性等也无法避免,治疗过程中的安全性等仍然需要我们关注。目前,借助CRISPR基因编辑技术,治疗中已经实现高效多点地定向编辑T 细胞,解决治疗过程中副作用较强、实体瘤效果较差、个体疗效差异大以及细胞扩增数量不足难以商业化等问题。未来基因工程技术与细胞疗法的联合应用,有望在肿瘤治疗领域拓展一片新天地。
参考文献:
[1] Gross G, Waks T, Eshhar Z. Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody type specificity[J]. Proc Natl Acad Sci USA, 1989, 86 (24):10024-10028.
[2] Sadelain M, BrentjensR, RiviereI,et al. CD19 CAR Therapy for Acute Lymphoblastic Leukemia [J]. Am Soc Clin Oncol Educ Book, 2015, 2015:e360-e363.
[3] Park J H, RiviereI, Gonen M, etal. Long-Term Follow-up of CD19 CAR-Therapy in Acute Lymphoblastic Leukemia[J]. N Engl J Med, 2018, 378:449-459.
[4] Cao J, Wang G, Cheng H, etal. Potent anti-leukemia activities of humanized CD19-targeted Chimeric antigen receptor T (CAR-T) cells inpatients with relapsed/refractory acute lymphoblastic leukemia[J]. Am J Hematol, 2018, 93:851-858.
[5] Beatty Gl, Haas Ar, Maus Mv, et al. Mesothelin specific chimeric antigen receptor mRNA engineered T cells induce anti-tumor activity in solid malignancies [J]. Cancer Immunol Res, 2014, 2(2): 112-120.
[6] Ahmend N, Brawley Vs, Hegde M, et al. Human epidermal growth factor receptor 2 ( HER2) specific chimeric antigen receptor modified T cells for the immunotherapy of Her2 positive sarcoma[J]. J Clin Oncol, 2015, 33(15): 1688-1696.
[7] Xianbao Zhan, Bin Wang, Zonghai Li, et al. Phase I trial of Claudin 18.2-specific chimeric antigen receptor T cells for advanced gastric and pancreatic adenocarcinoma. Journal of Clinical Oncology, 2019, 37(15):2509-2509.
[8] Shi D, Shi Y, Kaseb AO, Qi X, Zhang Y, Chi J, Lu Q, Gao H, Jiang H, Wang H, Yuan D, Ma H, Wang H, Li Z, Zhai B. Chimeric Antigen Receptor-Glypican-3 T-Cell Therapy for Advanced Hepatocellular Carcinoma: Results of Phase I Trials. Clin Cancer Res, 2020, 26(15):3979-3989.
- 1国际TOP10医学期刊药物治疗信息 (2024年2月)2024-03-12 08:47:07
- 2国际TOP10药学期刊文章信息 (2024年2月)2024-03-11 11:42:42
- 3治疗药物监测杂志文章信息(2024年第46卷第1期)2024-02-26 13:25:52
- 4国际TOP10医学期刊药物治疗信息 (2024年1月)2024-02-06 10:02:48
- 5国际TOP10药学期刊文章信息 (2024年1月)2024-02-05 07:55:30
- 6治疗药物监测杂志文章信息(2023年第45卷第6期)2024-01-10 08:34:12
- 7国际TOP10医学期刊药物治疗信息 (2023年12月)2024-01-08 14:34:41
- 8国际TOP10药学期刊文章信息 (2023年12月)2024-01-05 14:43:14
- 9国际TOP10医学期刊药物治疗信息(2023年11月)2023-12-14 12:22:30
- 10中国药师协会治疗药物监测药师分会于12月10日完成换届(附第二届委员名单)2023-12-11 16:10:33

 京公网安备11010502042549号
京公网安备11010502042549号